根据下列材料,按要求完成任务。 材料一《普通高中化学课程标准(实验)》 【内容标准】能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律;认识化学键的涵义,知道离子键和共价键...
材料一《普通高中化学课程标准(实验)》
【内容标准】能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律;认识化学键的涵义,知道离子键和共价键的形成。
材料二某教科书的知识结构体系
第一章物质结构元素周期律
第一节元素周期表
第二节元素周期律
第三节化学键
第二章化学反应与能量
第三章有机化合物
第四章化学与自然资源的开发利用
材料三某版本化学必修2教材“化学键”内容。
从元素周期表我们可以看出,到目前为止,已经发现的元素只有一百多种。然而,由这一百多种元素的原子组成的物质却数以千万计。那么,元素的原子通过什么作用形成如此丰富多彩的物质呢?
一、离子键
【实验1-2】
取一块绿豆粒大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。
待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方(如图1—10),观察现象。


思考与交流
1.画出钠和氯的原子结构示意图。
2.试解释氯化钠是怎样形成的。
要求:
(1)回答材料三“思考与交流”中的问题1和问题2。
(2)完成“离子键”的教学设计片段,内容包括教学目标、教学方法和教学过程(不少于300字)。
参考解析: (1)问题1:

问题2:
钠与氯气反应时,钠原子的最外层上的1个电子转移到氯原子的最外电子层上,形成带正电的钠离子和带负电的氯离子。带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成于化合物氯化钠。
(2)教学设计如下:
(一)教学目标
知识与技能:了解离子键的定义,了解离子键的形成过程;知道电子式的书写方法,并能用电子式表示离子化合物的形成过程。
过程与方法:通过离子键形成过程的学习,具有抽象思维和综合概括能力;通过电子式的书写,具有归纳比较能力。
情感态度与价值观:用对立统一规律认识问题:通过对离子键形成过程的分析,具有怀疑、求实、创新的精神,掌握由个别到一般的研究问题的方法。
(二)教学方法
阅读、讨论、练习、探究等。
(三)教学过程
【视频引入】播放视频,强调到目前为止,已经发现的元素只有一百多种,而这些元素组成的物质却有数千万种,那么原子是通过什么作用结合在一起的呢这是我们本节书要讨论的问题。
【板书】第三节化学键
【演示】教师演示实验1—2,学生注意观察并归纳实验现象,写出化学方程式,填在学案上的表格中。
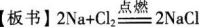
【设问】从宏观上看,钠和氯气发生了化学反应,生成了新物质氯化钠。如若从微观的角度,又应该怎样理解上述反应呢
【探究】NaCl的形成过程,讨论完成下列表格:

【过渡】既然钠离子与氯离子结合非常稳定,那么它们之间肯定存在着某种相互作用,这种作用就是离子键。
【板书】一、离子键
b.形成离子键的微粒是什么
c.离子键的成键本质是什么
【强调】成键的原因:得、失电子成为阴阳离子
成键的粒子:阴、阳离子
成键的本质:静电作用(吸引和排斥)
【课件演示】可用多媒体课件演示NaCl的形成过程,让抽象变得直观。
【讨论】Na+、Cl-之间存在哪些作用力只存在阴阳离子间的吸引力吗
【强调】Na+、Cl-之间存在着:阴、阳离子间的吸引、原子核间的排斥、电子之间的排斥,因此静电作用既包括静电吸引又有静电排斥。
【归纳】阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成离子键。
【过渡】离子键只存在离子化合物中,那什么是离子化合物呢
【板书】2.离子化合物:由离子键构成的化合物。

【讨论】离子化合物包含哪些物质类别呢形成离子键的元素有哪些
【归纳】离子化合物所属类别:强碱、部分活泼金属氧化物、大部分盐。
形成离子键的元素:活泼的金属元素(ⅠA,ⅡA)与活泼的非金属元素(ⅥA,ⅦA)。
【强调】酸不是离子化合物。
【过渡】由于在化学反应中,一般是原子的最外层电子发生变化,为了方便分析化学反应实质,我们引进了只表示元素原子最外层电子的一种式子——电子式。
【板书】3.电子式
在元素符号周围用小黑点(或×)来表示原子的最外层电子的式子
【强调】元素符号周围标最外层电子数
【阅读】课本21页资料卡片,理解Na、Cl、Mg、S原子电子式的写法。
【讲解】阴阳离子和离子化合物的电子式的书写方法。
【练习】写出钙离子、氟离子、氧离子的电子式。
【投影】将学生书写过程中出现的各种错误展示于投影上,由其他同学纠正。
【过渡】这样,我们就可以很方便地用电子式来表示出离子化合物氯化钠的形成过程。
【板书】
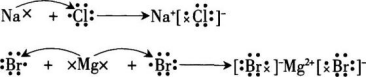
【练习】1.完成投影上的选择题。
通过纠错,得出用电子式表示离子化合物的形成过程应注意的事项。
【强调】注意事项:(1)离子须标明电荷数;
(2)离子要单个写;
(3)阴离子要用方括号括起;
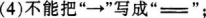
(5)用箭头标明电子转移方向(方向不能错);
【小结】本节课你有哪些收获
【作业】完成学案上的练习。



 百度扫一扫练题
百度扫一扫练题
 关注千题库公众号
关注千题库公众号








